タンパク質の動きが病気を引き起こす- パーキンソン病の原因タンパク質の分子運動を観測することに成功 -
令和元年8月26日
国立研究開発法人量子科学技術研究開発機構
国立大学法人名古屋大学
国立研究開発法人日本原子力研究開発機構
J-PARCセンター
【発表のポイント】
〇 パーキンソン病の発症に関係するタンパク質「α-シヌクレイン」の分子の運動を、中性子を利用した最先端の分析技術及び新たに開発した解析法を用いて測定
〇 正常なタンパク質分子の特定の運動が、分子が集合して「アミロイド線維」と呼ばれる異常な塊を作る過程に関与することを世界で初めて発見
〇 パーキンソン病をはじめとしたアミロイド線維が関わるさまざまな病気の発症のメカニズムを解明する手がかりとなることに期待
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫。以下「量研」という。)量子生命科学領域の 藤原 悟 専門業務員、松尾 龍人 主任研究員、河野 史明 研究員、名古屋大学シンクロトロン光研究センターの 杉本 泰伸 准教授、構造生物学研究センターの 成田 哲博准教授、松本 友治 研究員、国立研究開発法人日本原子力研究開発機構(理事長 児玉敏雄)J-PARCセンターの 柴田 薫 常勤特別嘱託らは共同で、脳内に存在する正常なタンパク質「α-シヌクレイン1)」の分子の特定の運動が、パーキンソン病発症のカギとなる「アミロイド線維2)」という異常な塊を作り出す原因となることを突き止めました。中性子準弾性散乱3)装置を用いて「α-シヌクレイン」の運動を分子レベルで調べたところ、線維状の集合は、このタンパク質の折れ曲がり運動と内部の局所的運動が同時に起こることでもたらされることを世界で初めて発見しました。
現在、その機能に関してはまだ不明な点が多い「α-シヌクレイン」というタンパク質が、「アミロイド線維」という異常な集合体を作りはじめることが、パーキンソン病の発症に関与しているとされています。正常なタンパク質が異常な状態に陥ってしまう、そのきっかけが何であるのかはまだ解明されていません。本研究は、この「きっかけ」の解明に、大きく貢献できることが期待されます。
一般に、タンパク質分子が集合して異常な状態を形成していくのは、正常に折りたたまれたタンパク質分子の構造の一部が「ほどけて」しまい、フラフラと動きやすくなることがきっかけになると言われています。そこで研究チームは、「α-シヌクレイン」分子の運動の特徴を詳細に調べることが重要と考えました。一口に「分子の運動」と言っても、全体の移動、大きな折れ曲がり、局所的なゆらぎ等の種類があります。そこで量研では、中性子準弾性散乱により分子の折れ曲がり運動と分子内部の局所的運動を個別に調べることのできる方法を新たに開発しました。J-PARC4)の中性子準弾性散乱装置を用いて実験を行い、この方法で解析した結果、アミロイド線維ができるためには、「α-シヌクレイン」分子の折れ曲がり運動と分子内部の局所的運動の両方が同時に活発でなければならないことを発見しました。
本成果によって、これまで謎であった「α-シヌクレイン」からアミロイド線維が形成される最初の過程について、分子の折れ曲がり運動と分子内部の局所的運動に注目すべきことがわかりました。これにより、アミロイド線維形成機構の科学的解明の糸口が得られたことはもちろん、タンパク質分子の特定の運動に着目し、それを抑制する薬剤分子を探索・開発するという、まったく新しい観点からのパーキンソン病治療/予防法の開発へとつながることが期待されます。
さらに、アミロイド線維の形成は、パーキンソン病だけでなく、アルツハイマー病5)や家族性アミロイドポリニューロパチー6)など、さまざまな病気の発症と関わっていることが知られており、本研究成果は、これらの病気の発症メカニズムの解明と治療/予防法の開発にも寄与できると考えられます。
この研究成果は、分子生物学・生物物理学分野における国際科学誌「Journal of Molecular Biology」にオンライン掲載(2019年6月8日付)されました。
本件に関するお問い合わせ先
<研究内容について>
国立研究開発法人量子科学技術研究開発機構 量子生命科学領域 専門業務員 藤原 悟
TEL : 070 -3943 -3436
メールアドレス : fujiwara.satoru[at]qst.go.jp
<報道対応>
国立研究開発法人量子科学技術研究開発機構 経営企画部 広報課長 松橋 信平
TEL : 043 -206 -3062、FAX : 043 -206 -4062
※上記の[at]は@に置き換えてください。
研究開発の背景と目的
パーキンソン病は進行性の神経難病で、脳内の神経細胞がゆっくりと死んでいくことで、身体の運動の調節がうまくいかなくなる病気です。50~60歳代で発症することが多く、高齢になるほど発症率が高くなる(患者数:1~1.5人/1000人、但し60歳以上では1人/100人となる)ため、全世界的に高齢化が急速に進展すると見込まれている現在、その治療や予防は社会的にも重大な関心事です。パーキンソン病の患者の脳細胞には、「α-シヌクレイン」という健常な脳内にも存在するタンパク質が、「アミロイド線維」と呼ばれる異常な線維状態となって蓄積していることが知られており、このアミロイド線維の形成がパーキンソン病発症のカギとされています。アミロイド線維の形成過程を明らかにすることは、医学にとって非常に重要な課題ですが、残念ながら未解明のままです。
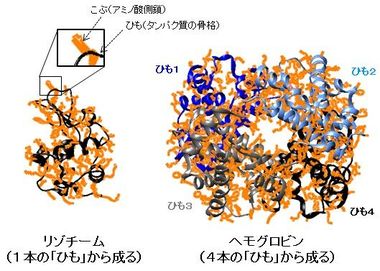
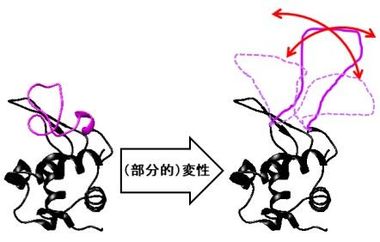
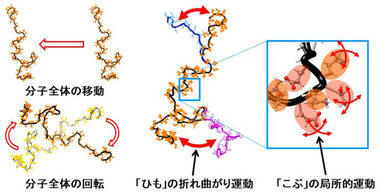
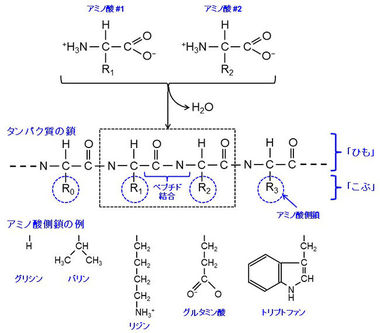
タンパク質は、たくさんのアミノ酸が数珠つなぎにつながってできていますが、その骨格である「ひも」からアミノ酸側鎖7)の「こぶ」がたくさん突き出ています。通常は、その「ひも」と「こぶ」がきちんと折り畳まれて特定の構造を形成し(図1)、本来の機能を発揮します。ところが、何らかの原因で、折り畳まれた構造の全体あるいは一部がほどけてしまい、「ひも」がグニャグニャになり、動きやすくなってしまうこと(「変性」という)があります(図2)。また、この部分から突き出ている「こぶ」も、ふらふらと動きやすくなります。一般に、このタンパク質の「変性」がきっかけとなり線維の形成が始まるため、アミロイド線維形成の仕組みを明らかにするには、この「ひも」や「こぶ」の動きを詳細に調べることが重要です。
量研のチームは、2016年に、アミロイド線維を形成した後の状態の「α-シヌクレイン」の動きを調べ、線維状態では、タンパク質同士が強く結合して動きが制限されているにも関わらず、分子が局所的に大きく動くことを突き止めていました。本研究は次のステップとして、線維が形成される過程について取り組みました。
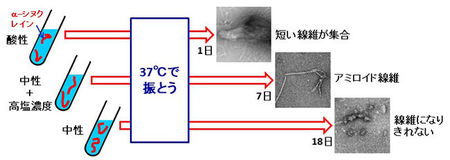
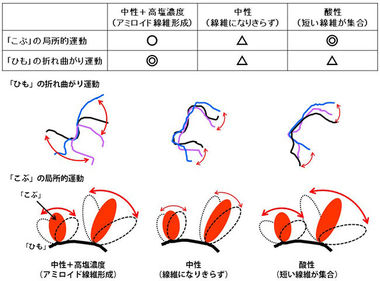
「α-シヌクレイン」は、どんな環境でもアミロイド線維を形成できるわけではありません。体内の環境に近い中性で生理的濃度に近い塩(以下「高塩濃度」)の入った溶液ではアミロイド線維を形成することができますが、中性でも塩が入っていなければ、集合が足りず、線維になりきれないこと、また、酸性溶液中では線維が長くなる前に短い線維同士が急速に集合し、大きな塊を作ってしまうことが知られていました(図3)。このような様々な条件下での「α-シヌクレイン」の分子の運動を解析すれば、どのような動きがアミロイド線維の形成をもたらすかを明らかにすることができると考えました。
図1.一般的なタンパク質の構造の例(タンパク質の骨格の「ひも」(黒~青の線)とアミノ酸側鎖の「こぶ」(オレンジ色の部分)
図3.溶液の違いによる「α-シヌクレイン」のアミロイド線維のできやすさの違い
今回、体内環境に近い中性で高塩濃度の溶液、中性で塩の入っていない溶液、酸性の溶液中のそれぞれについて、「α-シヌクレイン」分子の「ひも」の折れ曲がり運動と「こぶ」の局所的運動の特徴を調べました。実験には、中性子準弾性散乱という手法を用いました。これは、中性子がタンパク質内にたくさん存在する水素原子とぶつかりやすいことを利用して、その跳ね返り方を調べることにより、タンパク質の運動を調べる手法です。中性子準弾性散乱実験は、世界最先端の中性子実験施設であるJ-PARCの物質・生命科学実験施設で行いました(図4)。測定に用いた試料の調製は量研、中性子準弾性散乱実験と解析は量研およびJ-PARCセンター、実験データの解析に必要なその他の実験(X線小角散乱8)実験、動的光散乱9)実験、電子顕微鏡10)撮影)は量研と名古屋大学が担当しました。

図4. 中性子準弾性散乱を測定するダイナミクス解析装置(DNA)
研究の手法と成果
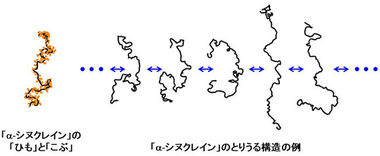
「α-シヌクレイン」は140個のアミノ酸からなるタンパク質で、1本の「ひも」から140個の「こぶ」が突き出ています(図5)。「α-シヌクレイン」は、「ひも」が特定の構造を持たない特殊なタイプのタンパク質(天然変性タンパク質11)と呼ばれる;図5)であることが知られているので、その分子の動きを考えると、分子全体の移動や回転の他に、「ひも」が常に伸びたり曲がったりしている動きと、140個の「こぶ」それぞれが常にゆらいでいる動きが想定できます(図6)。
タンパク質の「ひも」の折れ曲がり運動や「こぶ」の局所的運動は、測定すること自体が極めて難しく、定量的な測定はこれまでほとんど行われていません。「こぶ」の局所的運動を直接、詳細に測定できるのは、現在のところ中性子準弾性散乱のみです。さらに、今回、量研のチームは、中性子準弾性散乱のデータと追加測定したX線小角散乱および動的光散乱のデータを組み合わせることで、タンパク質の「ひも」の折れ曲がり運動を調べることのできる新しい解析法を開発しました。今回の研究では、この新しい解析法を用いることにより、世界で初めて「ひも」の折れ曲がり運動と「こぶ」の局所的運動を同時に調べることができました。
図7に研究の結果をまとめました。まず、「こぶ」の局所的運動は、「α-シヌクレイン」の集合が足りず線維になり切れない条件(中性で塩がない)で最も小さく、アミロイド線維が形成される条件(中性+高塩濃度)ではそれよりも大きく、短い線維が急速に集合してしまう条件(酸性)では、さらに大きくなることがわかりました。これは、「α-シヌクレイン」同士が結合することに「こぶ」の局所的運動が働いていることを示しています。一方、「ひも」の折れ曲がり運動は、アミロイド線維が形成される条件(中性+高塩濃度)で大きく、他の2つでは小さいことがわかりました。これは、問題となる繊維状の構造を「α-シヌクレイン」が形成するためには、「ひも」の折れ曲がり運動が必須であることを示しています。以上のように、アミロイド線維を形成する過程では、「α-シヌクレイン」の「こぶ」の局所的運動と「ひも」の折れ曲がり運動の両方が同時に活発でなければならないことが、中性子準弾性散乱によって世界で初めて観測されました。
図7.さまざまな溶液中での「α-シヌクレイン」の運動の特徴のまとめ
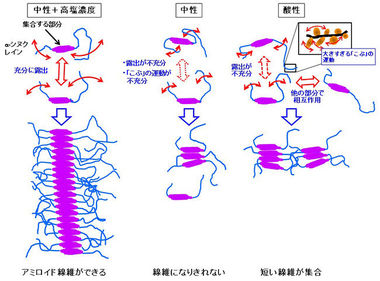
図8に今回の結果から推測されるアミロイド線維形成過程の仕組み(モデル)を示します。アミロイド線維は「α-シヌクレイン」の中央部分同士で結合することが従来から知られていました。分子同士が相互作用するためには、まず「こぶ」の局所的運動が必要であり、さらに、アミロイド線維ができるためには、「ひも」の折れ曲がり運動によって分子の中央部分が充分露出し、相互作用できるようになることが必要と考えられます。
図8.さまざまな溶液中での「α-シヌクレイン」の動き方の違いとアミロイド線維のできやすさの関係
本成果は、アミロイド線維形成の仕組みを解明するための大きな手がかりとなり、さらにその知見に基づき「ひも」の折れ曲がり運動や「こぶ」の局所的運動を抑える薬を開発することで、パーキンソン病の新しい治療・予防薬の開発へとつながることが期待されます。
今後の展開
本研究の特色は、正常なタンパク質の「特定の運動」が、疾病発症の原因とされるアミロイド線維などの異常な構造ができる原因となることを示した点にあります。これは、その運動を抑えることで異常な構造の形成を抑えることができる可能性を示しています。今後、「α-シヌクレイン」の分子の中のどの部分が曲がりやすいかなど、より詳しく運動を調べていくことで、「タンパク質の運動の制御」という全く新しい考え方に基づく創薬につながっていくことが期待されます。
また、アミロイド線維は、「α-シヌクレイン」によるパーキンソン病に関係したもののみではなく、レビー小体型認知症12)やアルツハイマー病などの様々な認知症や家族性アミロイドポリニューロパチーをはじめとする種々の難病の発症に関係しています。それぞれの疾病に関連するタンパク質について系統的に調べていくことで、アミロイド線維形成と疾病発症の根本的な関係の解明に繋がることが期待されます。
本研究の一部は、日本学術振興会科学研究費助成事業(16K13730、26293210)の支援を受けて実施されました。
論文掲載情報
掲載誌:「Journal of Molecular Biology」2019年6月8日オンライン掲載
論文タイトル:Dynamic Properties of Human α-Synuclein Related to Propensity to Amyloid Fibril Formation
著者:S. Fujiwara, F. Kono, T. Matsuo, Y. Sugimoto, T. Matsumoto, A. Narita, and K. Shibata
DOI:10.1016/j.jmb.2019.05.047
用語説明
ヒト脳神経細胞の末端部に大量に存在するタンパク質で、脳細胞間の信号のやりとりに関係した様々な働きがあると言われているがまだその正常での機能に関しては不明な点が多い。このタンパク質のアミロイド線維化が、パーキンソン病の発症と密接に関係すると言われている。シヌクレインは天然変性タンパク質の一つで、下記項目 11)で説明するように、溶液中で、特定の構造を持たず、さまざまな構造の間をゆらいでいる。
通常のタンパク質は、単独でバラバラに存在し、あるいはいくつかのタンパク質が正しく集まりきちんとした構造体を形成して、機能を発揮する。ところが、何らかの異常により、タンパク質同士が線維状に集合した状態となることがある。このタンパク質の線維状の異常な集合体をアミロイド線維という。パーキンソン病をはじめ、アルツハイマー病や家族性アミロイドポリニューロパチーに代表される全身性アミロイドーシスなど種々の疾病において、その患者の体内にアミロイド線維が沈着していることが報告されており、アミロイド線維形成とこれらの疾病の発症には密接な関係があると言われている。
中性子は、物質を構成する最小基本粒子のひとつである。加速器や研究用原子炉により発生させた中性子ビームを用いて、物質の様々な性質を調べることができる。中性子ビームを分子に当てると、分子に当たった中性子は散乱される。散乱された中性子は、分子とのエネルギーのやり取りのため、そのエネルギーが変化している。このエネルギー変化を伴う中性子の散乱を中性子準弾性散乱という。中性子ビームを分子に当て、準弾性散乱された中性子の方向やエネルギー変化を調べることにより、分子の運動の大きさや速さなどを解析することができる。
4)J-PARC(大強度陽子加速器施設;Japan Proton Accelerator Research Complex)
日本原子力研究開発機構と高エネルギー加速器研究機構が共同で運営している加速器実験施設。陽子加速器群と、物質・生命科学実験施設、ニュートリノ実験施設、ハドロン実験施設の実験施設群から成り、物質科学、生命科学、素粒子物理、原子核物理など幅広い分野の研究が行われている。本研究では、物質・生命科学実験施設の中性子準弾性散乱装置を用いて実験を行った。
記憶や思考能力が徐々に損なわれ、最終的には日常生活を行う能力も失われてしまう不可逆的な進行性の脳疾患で、認知症の原因として最も多い疾患である。アルツハイマー病患者の脳の病理解剖で、老人班と呼ばれる数10~100 mの大きさの構造物が多く見つかるが、その主成分が、「アミロイドβタンパク質」のアミロイド線維であることから、このタンパク質のアミロイド線維形成が発症と密接な関係があると言われている。
血清中のタンパク質の変異により全身の様々な臓器にアミロイド線維が沈着し、機能障害を起こす病気の一種で、神経障害を主な症状とするものをいう。種々の病型があるが、特に「トランスサイレチン」というタンパク質の変異が原因での発症の頻度が最も高い。
タンパク質はアミノ酸が重合して1本の鎖を形成したものである。アミノ酸は、アミノ基とカルボキシル基を持ち、右図のように、アミノ酸同志の脱水縮合でペプチド結合を形成し、鎖を形成していく。タンパク質を作るアミノ酸は20種類あるが、アミノ酸毎に側鎖の組成が異なり、その大きさ、電荷分布などが異なる。ペプチド結合で連なっていく主鎖の部分が「ひも」であり、突き出たアミノ酸側鎖が「こぶ」となる。タンパク質を形成する鎖のアミノ酸の配列はタンパク質毎に異なるので、タンパク質毎に側鎖の並び方が異なる。この側鎖の並び方の違いがタンパク質の個性の違いとなり、性質、機能の違いとなる
X線を物質に照射し、散乱されたX線の強度を測定することで物質の構造情報を得る手法で、散乱角の小さいX線の測定から物質のナノスケールの情報が得られる。タンパク質の溶液試料の測定から、タンパク質の溶液中での構造情報、特に、タンパク質の形状に関する情報が得られるので、タンパク質の構造研究でもしばしば用いられる。
レーザー光を目的とする粒子を含む溶液に照射し、その散乱光の時間変化を測定することで、粒子の移動のしやすさを表す拡散係数を測定する方法である。タンパク質溶液の測定の場合、タンパク質全体の移動のしやすさを調べることができる。
可視光を用いる通常の光学顕微鏡と異なり、電子線を用いて観察することにより、光学顕微鏡よりはるかに解像度が高く、ナノスケールの構造を観察することができる顕微鏡である。
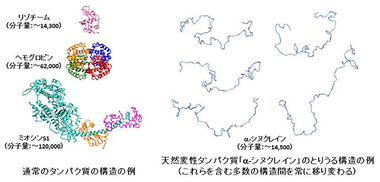
通常のタンパク質はアミノ酸がつながった「ひも」および側鎖の「こぶ」がきちんと折り畳まれ、特定の構造を持つが、「ひも」の全てあるいは一部の領域が、特定の構造を持たずに様々な構造間をゆらいでいるタンパク質が存在する(下図参照)。即ち、これらのタンパク質は、自然の状態で「ひも」が変性しているために、天然変性タンパク質と呼ばれる。シヌクレインは代表的な天然変性タンパク質の一つである。ヒトの全タンパク質の約30% が天然変性タンパク質あるいは天然変性領域を持つタンパク質と言われており、生命現象が発揮される上での天然変性タンパク質の役割は重要と考えられる。
レビー小体型認知症とは、老年期に認知症を呈する病気の一つで、アルツハイマー型認知症についで多い病気で、高齢者の認知症の約20%を占めている。記憶障害を中心とした認知症と、動作が遅くなり転びやすくなるパーキンソン症状、繰り返す幻視がみられる。